Engineer Physics/Matter/Chemical chracteristics
Chemical substance's state[edit]
All chemical substance exists in 4 states
Chemical element[edit]
Chemical element is the smallest smallest particle that makes up chemical substance
In the late 1800's, Russian scientist Dmitri Mendeleev was credited with creating one of the first organized periodic tables. Organizing each element by atomic weight, he cataloged each of the 56 elements discovered at the time. Aside from atomic weight, he also organized his table to group the elements according to known properties.There are 102 chemical elements are discovered and listed in a table called Peridic chemical element table as shown below
Atom[edit]
In the beginning of 20 century, John Dalton discovered atom is the basic building block of chemical element and he went on published his atomic theories in 1803. His theory consists of five important points, which are considered to be mostly true today: (from Wikipedia)
- Elements are composed of tiny particles called atoms.
- All atoms of a given element are identical.
- The atoms of a given element are different from those of any other element; the atoms of different elements can be distinguished from one another by their respective relative weights.
- Atoms of one element can combine with atoms of other elements to form chemical compounds; a given compound always has the same relative numbers of types of atoms.
- Atoms cannot be created, divided into smaller particles, nor destroyed in the chemical process; a chemical reaction simply changes the way atoms are grouped together.
We now know that elements have different isotopes, which have slightly different weights. Also, nuclear reactions can divide atoms into smaller parts (but nuclear reactions aren't really considered chemical reactions). Otherwise, his theory still stands today.
Sub atomic Charged particle[edit]
Discovered of charged particles[edit]
In the year 1889 the British physicist J.J. Thomson discovered the electron.Soon after the discovery of the electron, Thomson began speculating on the nature of the atom. He suggested a "plum pudding" model. In this model the bits of "plum" were the electrons which were floating around in a "pudding" of positive charge to match that of the electrons and make an electrically neutral atom. A modern illustration of this idea would be a chocolate chip cookie, with the chips representing negatively charged electrons and the dough representing positive charge.
Charged particle[edit]
Charged particle is the smallest indivisible particle that makes up atom
Charged particle Mass Charge Symbol Electron 9.1094 × 10−31 kg −1.602 × 10−19 C e- Proton 9.1094 × 10−31 kg +1.602 × 10−19 C p+ Neutron 1.6726 ×10-27 kg 0 C 0
Atomic's structure model[edit]
Ruther fords Atomic model of atom[edit]
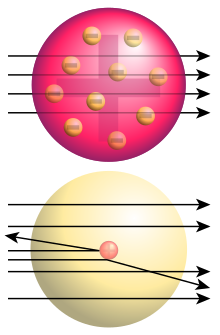
Ernest Rutherford is known for his famous gold foil experiment in 1911. Alpha particles, which are heavy and positively charged (actually, helium nuclei, but that's beside the point), were fired at a very thin layer of gold. Most of the alpha particles passed straight through, as expected. According to the plum pudding model all of the particles should have slowed as they passed through the "pudding", but none should have been deflected. Surprisingly, a few alpha particles were deflected back the way they came. He stated that it was "as if you fired a 15-inch shell at a piece of tissue paper and it came back and hit you."
The result of the experiment allowed Rutherford to conclude that the plum pudding model is wrong.
- Atoms have a nucleus, very small and dense, containing the positive charge and most of the atom's mass.
- The atom consists of mostly empty space.
- The electrons are attracted to the nucleus, but remain far outside it.
200px|right
- Mọi vật được tạo ra từ Nguyên tố hóa chất, phần tử nhỏ nhứt còn giử tính chất của vật
- Mọi Nguyên tố vật chất được tạo từ các phần tử điện nhỏ nhứt không thể phân chia gọi là Nguyên tử điện
- Mọi Nguyên tử điện đều có các vòng tròn Quỷ đạo chứa Điện tử âm quay quanh một Hạt nhân ở trong tâm chứa các Điện tử dương và Điện tử trung hòa
- Số nguyên tố cho biết số lượng điện tủ âm trên các Quỷ đạo và số lượng điện tủ dương trong Hạt nhân
- Ở trạng thái cân bằng, tổng điện của nguyên tử bằng không
- Chỉ có điện tử âm trên quỷ đạo ngoài cùng mới có thể tham gia các phản ứng điện
Neil Boh's Atomic model of atom[edit]
- Các điện tử chuyển động xung quanh hạt nhân theo các quỹ đạo có năng lượng và bán kính cố định.
- Năng lượng của điện tử phụ thuộc vào bán kính quỹ đạo của điện tử
- Điện tử nằm trên quỹ đạo có bán kính lớn nhất sẽ có năng lượng nghỉ nhỏ nhất và năng lượng động cao nhất
- Năng lượng ở mức năng lượng ổn định hay ở trạng thái ổn định .
- Nếu Nguyên tử hấp thụ năng lượng của một Lực (Điện , Ánh sáng ...) năng lượng của Nguyên tử sẻ thay đổi lúc này điện tử nằm ở trạng thái kích thích
- Điện tử trở thành điện tử tự do khi điện tử hấp thụ hay giải thoát năng lượng quang tuyến . Điện tử sẻ đi ra khỏi nguyên tử khi điện tử hấp thụ năng lượng quang tuyến . Điện tử sẻ đi vô trong nguyên tử khi điện tử giải thoát năng lượng quang tuyến
Tính toán Bohr[edit]
- Vạch sáng Line spectra
Vạch sáng Lyman
- . Với n=2,3,4 ... 91-122nm
Vạch sáng Balmer
- . Với n=3,4,5 ... 365-656nm
Vạch sáng Paschen
- . Với n=4,5,6 ... 820-1875nm
- Bán kín Bohr
Cho lực Coulomb bằng lực ly tâm
Bohr điều kiện để lượng tử hóa của góc độn lượng
Giải tìm v
Thế v vào r
Với Hydrogen Z=1, n=1
- được biết là bán kín Bohr Bohr radius
- Tầng năng lượng lượng tử
Với Hydrogen Z=1
n được biết là số lượng tử Principal quantum number

























